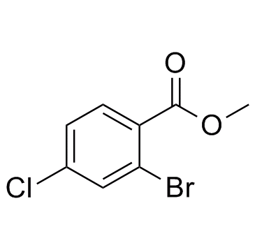
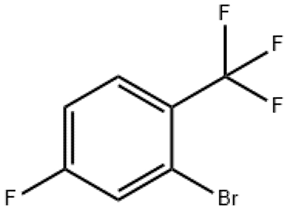
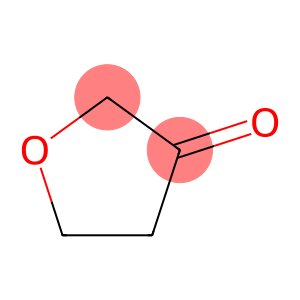
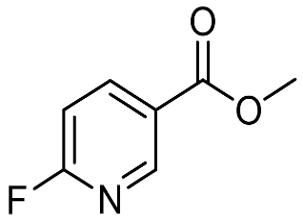
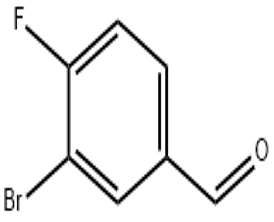
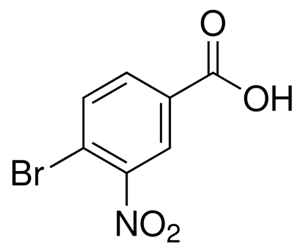
alfa-jonons (CAS#127-41-3)
| Riska kodi | R42/43 – Ieelpojot un saskaroties ar ādu, var izraisīt paaugstinātu jutīgumu. |
| Drošības apraksts | S24/25 – Izvairīties no saskares ar ādu un acīm. |
| WGK Vācija | 2 |
| RTECS | EN0525000 |
| TSCA | Jā |
| HS kods | 29142300 |
alfa-jonons (CAS#127-41-3) informāciju
Violetais ketons, pazīstams arī kā benzofenons, ir organisks savienojums. Šeit ir daži drošības dati par ionone:
1. Toksicitāte: Violetajam ketonam ir noteikta toksicitāte cilvēka ķermenim. Tas var izraisīt centrālās nervu sistēmas un aknu bojājumus, kā arī nelabvēlīgi ietekmēt reproduktīvo sistēmu un embrijus.
2. Bīstamība ieelpojot: Jonona tvaiku vai putekļu ieelpošana var izraisīt diskomforta simptomus, piemēram, reiboni, miegainību, klepu un apgrūtinātu elpošanu. Ilgstoša iedarbība var izraisīt centrālās nervu sistēmas bojājumus.
3. Saskares bīstamība: Violetais ketons var uzsūkties caur ādu. Ilgstoša vai plaša saskare var izraisīt ādas un acu kairinājumu. Strādājot ar iononu, jāvalkā atbilstoši individuālie aizsardzības līdzekļi, piemēram, cimdi un aizsargbrilles.
4. Ugunsdzēsības pasākumi: Noplūdes vai ugunsgrēka gadījumā uguns dzēšanai izmantojiet sausu pulveri, putas vai oglekļa dioksīdu. Izvairieties no ūdens lietošanas, jo violetais ketons reaģē ar ūdeni, veidojot uzliesmojošas gāzes.
5. Atkritumu iznīcināšana: Lietojiet violetā ketona atkritumus pareizi saskaņā ar vietējiem noteikumiem un noteikumiem. Neizlejiet to kanalizācijā vai atkritumu tvertnē.
6. Uzglabāšanas pasākumi: Violetais ketons jāuzglabā vēsā, sausā, labi vēdināmā vietā, prom no uguns avotiem un oksidētājiem.
Šī informācija ir paredzēta tikai atsaucei. Ja nepieciešama turpmāka ionona lietošana vai apstrāde, lūdzu, skatiet attiecīgo drošības datu lapu un konsultējieties ar speciālistu.
dabu
Violetais ketons, pazīstams arī kā linailketons, ir dabisks ketona savienojums. Tā ir vijolīšu ziedu aromāta galvenā sastāvdaļa.
Violetais ketons ir bezkrāsains līdz gaiši dzeltens eļļains šķidrums, kas istabas temperatūrā ir gaistošs.
Violetais ketons šķīst spirtā un ētera šķīdinātājos un nedaudz šķīst ūdenī. Tā blīvums ir salīdzinoši zems, ar blīvumu 0,87 g/cm³. Tas ir jutīgs pret gaismu un spēj absorbēt ultravioletos starus.
Violeto ketonu ķīmiskās reakcijās var oksidēt par ketona spirtiem vai skābēm, un hidrogenēšanas reducēšanas reakcijās to var reducēt par spirtiem. Tas var iziet alkilēšanas un esterifikācijas reakcijas ar daudziem savienojumiem.
Pielietošanas un sintēzes metode
Violetais ketons (pazīstams arī kā purpursarkanais ketons) ir aromātisks ketona savienojums. Tam ir īpašs aromāts, un to bieži izmanto smaržu un parfimērijas rūpniecībā. Tālāk ir sniegts ievads par jonona lietojumiem un sintēzes metodēm:
Mērķis:
Smaržas un garšvielas: jonona smaržas īpašības, ko plaši izmanto smaržu un garšvielu rūpniecībā, lai ražotu vijolītes aromātu.
Sintēzes metode:
Jonona sintēzi parasti panāk, izmantojot šādas divas metodes:
Nukleobenzola oksidēšana: nukleobenzols (benzola gredzens ar metila aizvietotāju) tiek pakļauts oksidācijas reakcijai, piemēram, izmantojot oksidējošu skābi vai skābu kālija permanganāta šķīdumu, lai iegūtu jonu.
Pirilbenzaldehīda savienošana: pirilbenzaldehīds (piemēram, benzaldehīds ar piridīna gredzena aizvietotājiem para vai meta pozīcijā) tiek reaģēts ar etiķskābes anhidrīdu un citiem reaģentiem sārmainos apstākļos, veidojot jonu.